Los diagramas más usados para la interpretación de análisis hidroquímicos
No olvides apoyarme en Premios Bitácoras en la categoría de educación, aun tienes tiempo!!!.
Para el estudio e interpretación de datos derivados de análisis hidroquimicos, comúnmente se utilizan una serie de diagramas que vienen incorporados en software como Aquachem y Diagrammes. Entre estos tenemos:
Piper, Stiff, Schoeller, Durov, Ternary, mapas de distribución de diagramas de Stiff, Ludwig-Langelier, diagrama de Gibbs (boomerang), Wilcox y X-Y Scatter (graficos binarios), entre otros. A continuación se describe la construcción y uso de algunos de estos gráficos.
1. Digrama de Stiff
Esta gráfica está compuesta por tres ejes horizontales, cada uno de ellos uniendo un catión y un anión. Todos los cationes se disponen al costado izquierdo del diagrama, y los aniones al derecho. Siempre el Na+ se confronta con el Cl-, el Ca+2 con el HCO3- y el Mg+2 con el SO4-2 (a veces también se pueden mostrar otros dos iones, como el Fe+2 contra el NO3). Todos los ejes horizontales están a la misma escala (lineal) y las concentraciones están dadas en meq/l.
Dos características sobresalen en este tipo de diagrama: por un lado permite visualizar claramente diferentes tipos de agua (cada una con una configuración particular) y, en forma simultánea, permite dar idea del grado de mineralización (ancho de la gráfica), en la grafica siguiente se muestran algunas apreciaciones de este diagrama que caracterizan varios tipos de aguas.

Permite apreciar los valores de las relaciones iónicas con respecto a la unidad y la variación de las relaciones entre cationes y entre aniones de una muestra.
También pueden representarse en un mapa, con lo que se visualiza rápidamente la variación espacial de la mineralización del agua en el acuífero.

2. Diagram de Piper:
Es una de las gráficas más utilizadas, En el se incluyen aniones y cationes en forma simultánea. Este gráfico permite representar muchos análisis sin dar origen a confusiones. Las aguas geoquímicamente similares quedan agrupadas en áreas bien definidas (Custodio 1965).
Está formado por dos triángulos equiláteros, donde se representan los cationes y aniones mayoritarios. Los vértices del triangulo de cationes son Ca2+ , Mg2+ y Na++ K+. Los verticers del triangulo de aniones son SO4-2, Cl- y HCO3-. Los datos de los diagramas triangulares se proyectan en un rombo central en el que se representa la composición del agua deducida a partir de aniones y cationes.
Las concentraciones de los iones dadas en meq/l se expresan como porcentaje con respecto a la suma de aniones y cationes respectivamente. En cada triangulo se reúnen solo tres aniones y tres cationes. A cada vértice le corresponde el 100% de un anión o catión. Ver figura siguiente.

Para construir el diagrama de Piper se procede de la siguiente manera:
Paso1. Si las concentraciones están en mg/l, se convierten a meq/l dividiendo los mg/l de cada parámetro por el peso del miliequivalente correspondiente.
Ej: para convertir los 84 mg/l de Ca+2 correspondientes al punto 1 dividimos por 20 que es lo que pesa un meq de Ca+2. El resultado es 4.2 meq/l (ver tabla).

Paso 2. Expresamos como porcentaje los meq/l de cada parámetro, para ello: primero, sumamos los aniones y los cationes presentes en la muestra. En segundo lugar dividimos la concentración de cada parámetro por la suma de aniones o cationes según corresponda.
Por Ej. Para expresar los 4.2 meq/l de calcio que hay en la muestra, se debe tener en cuenta que la suma de cationes para es 5.53 meq/l, así.


Paso 3. Dibujar las proporciones en los gráficos triangulares. Se debe tener en cuenta que estos triángulos muestran solo las proporciones entre los aniones o los cationes mayores, no sus concentraciones.
Tal como se muestra en la figura de inicio, en unos de los vértices del triangulo de cationes se dibuja la suma de K++Na+, por tanto las cantidades a graficar son las siguientes.

Ahora se grafica el punto correspondiente a los cationes, conformado por 76% de Ca, 12% de Mg y 12% de Na+K, para ello, utilizamos con rectas auxiliares la opuesta cada uno de los vértices donde están el Ca, Mg y Na+K respectivamente .
Paralela a la recta opuesta al vértice del Ca, trazamos una línea por donde está el 76% de Ca (Línea verde).
Paralela a la recta opuesta al vértice del Mg, trazamos una línea por donde está el 12% de Mg (línea azul).
Paralela a la recta opuesta al vértice del Na+K, trazamos una línea por donde está el 12% de Na+K (línea roja).
En el sitio donde se cortan las tres rectas, se coloca el punto correspondiente a 76% de Ca, 12% de Mg y 12% de Na+K.
De igual forma de procede para los aniones conformado por 87% de HCO3, 6% de Cl y 7 % de SO4.
El resultado de todo este procedimiento se muestra en la figura siguiente.

Paso 4. Lo que sigue es proyectar ambos puntos en el rombo central, para ello se prolongan las líneas rojas de ambos triángulos. Donde se corten dichas líneas se localiza el punto que caracteriza la muestra, la cual se clasifica como Bicarbonatada – Cálcica (HCO3-Ca).

Este es un procedimiento que tal vez realizará una vez en la vida, puesto que existen software como el Aquachem (ya visto acá) y el Digrammes (del que próximamente estaré publicando un tutorial). Lo más importante es saber para qué sirve este diagrama:
Visualizar la evolución geoquímica de las aguas subterráneas.
Detectar procesos como intercambio catiónico.
Detectar mezclas entre dos tipos de agua.
Detectar procesos de dilución o precipitación de especies iónicas.
Junto con la cartografía y localización de los puntos de muestreo permite validar o lanzar hipótesis de la localización de la zona de recarga de los acuíferos.
A continuación se presentan casos tipos de agua, su clasificación y los procesos o rocas relacionadas con las mismas.
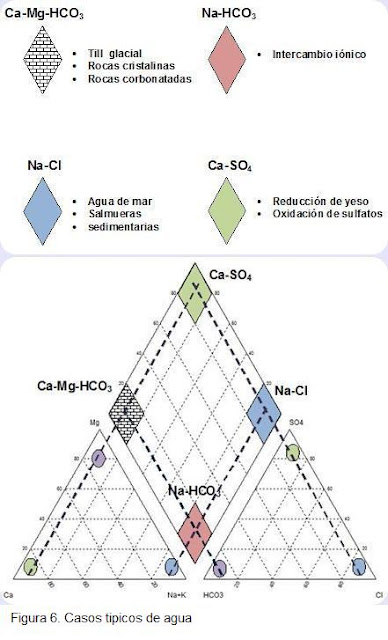
3. Schoeller- Barkalof
Se disponen varias semirrectas o columnas verticales paralelas, igualmente espaciadas y divididas en escala logarítmica y con el mismo módulo. A cada semirrecta se le asocia un anión o un catión, excepto la primera columna que no tiene asociada ningún ión y su unidad de medida es en meq/l, las demás tienen como unidad de medida mg/l.
El orden de las columnas es el siguiente:
- Columna 1: sin ión, unidad de medida meq/l
- Columna 2: Ca, unidad de medida mg/l
- Columna 3: Mg, unidad de medida mg/l
- Columna 4: Na, unidad de medida mg/l
- Columna 5: Cl, unidad de medida mg/l
- Columna 6: SO4, unidad de medida mg/l
- Columna 7: HCO3, unidad de medida mg/l
- Columna 8: NO3, unidad de medida mg/l
La columna No. 1 puede estar dividida de 0.1 hasta 1000 (meq/l), y las demás se deben configurar y colocar de tal manera que el peso del equivalente de cada ion coincida con el 1 de la primera columna, cuya escala es en meq/l (esto hace que las divisiones queden desplazadas). El peso equivalente de los iones anteriores es:

El resultado de lo dicho anteriormente, se muestra en la siguiente gráfica.

Como ejemplo se grafican los datos de la muestra del de diagrama de Piper anterior tal como se consigna en la siguiente tabla:

Estos valores los colocamos en cada una de las columnas correspondientes y luego unimos cada punto con una linea continua, el resultado se muestra en la siguiente gráfica.

Utilidad del diagrama de Schoeller- Barkalof
Se puede representar tanto aguas diluidas como concentradas en un mismo diagrama.
Permite clasificar los diferentes tipos de agua.
En una misma línea de flujo permite establecer la evolución del agua en el acuífero, así como determinar los procesos modificatorios, como intercambio iónico, procesos de oxido reducción y mezcla de diferentes tipos de agua.
Es muy útil para estudiar la evolución temporal de aguas subterráneas en un mismo punto.
4. Diagrama de Gibbs (boomerang).
En el diagrama de Gibbs es graficada la concentración de los sólidos disueltos totales (eje y) en función de la relación:

Se caracteriza por poseer tres zonas asociadas a los procesos de evaporación, interacción agua-roca y precipitación atmosférica.
Este diagrama es más aplicado a las aguas superficiales que subterráneas, de acuerdo a Langmuir (1979 citando a Gibbs, 1970), la química de aguas superficiales está determinada por tres factores: Lluvia (en el dominio de Precipitación); Reacciones de intemperismo (dominio de Roca); y el dominio de Evaporación-cristalización.
La composición de la lluvia mundial está determinada por el contenido de NaCl de origen marino y bajas concentraciones de sólidos disueltos por lo que se encuentran en la esquina inferior derecha. El incremento de sales debido a la interacción agua-roca causado por intemperismo aumenta la proporción de sólidos disueltos afectando las concentraciones de Calcio o Bicarbonato relativas a Sodio y Cloruros. Finalmente la evapotranspiración, como sucede en áreas de cultivo o superficies con suficiente aridez que reciben escurrimiento subsuperficial por aguas de retorno agrícola; elevan el contenido de Na+ y de sólidos disueltos TDS. En la figura siguiente se muestra el diagrama de Gibbs.

5. Diagramas Binarios
De estos existen tantos como se le puedan ocurrir a la persona que interpreta los datos, eso he observado en varios artículos que he leído. Se utilizan para representar la variación de un parámetro con respecto a otro.
En ocasiones, permiten visualizar la variación de varios parámetros con respecto a otro. Como por ejemplo, el Ca, Na, K, Mg, HCO3, Br, SO4 comparados con el Cl. Estos gráficos en conjunto permiten visualizar los efectos de interacción agua roca, mezcla de diferentes tipos de agua (agua dulce - agua de mar). Para comprender mejor este tema veamos un ejemplo extraído de Journal of Hydrology (B. Ladouche, P. Weng 2005) que se muestra en la grafica siguiente.
La correlación de las concentraciones de Na y Ba con Cl coindice con la línea de dilución teórica del agua de mar (a, b de la figura) que confirma fuertemente la influencia del agua marina en la composición química de las aguas del acuífero.
La correlación entre la concentración de Ca y Cl (a) indica que el agua subterránea de la formación Bri profunda (deep Bri groundwater) está sobre la línea de dilución del agua de mar, mientras que los puntos del agua subterránea de la formación Bri superficial (shallow Bri groundwater) muestran enriquecimiento en calcio y magnesio comparado con la línea de dilución del agua de mar (d). Los horizontes superficiales del acuífero Bri (2 m de profundidad) están enriquecidos en estroncio y los puntos correspondientes al agua subterránea de la formación Bri profunda, en su mayor parte están sobre la línea de dilución de agua de mar.
Estos resultados muestran, en primer lugar, que los efectos de interacción agua – roca dominan la composición química de las aguas subterráneas más superficiales de la formación Bri comparados con las aguas más profundas de la misma formación. En segundo lugar el origen de la mezcla con agua marina no se puede explicar con la composición química del agua en los depósitos de limo y arcilla de la formación Bri (B. Ladouche, P. Weng 2005).

Otras veces se utilizan para visualizar la variación de índices o relaciones.
En este caso tenemos la relación entre Ca+2+Mg+2–HCO3--SO4-2 en función de Na++K+–Cl-, la cual es útil para visualizar si presentan intercambio catiónico en el acuífero. El gráfico se construye sumando las concentraciones de los parámetros las cuales deben estar en meq/l (esto se puede hacer en Excel).

Luego graficamos los datos de las dos últimas columnas, quedando de la siguiente manera:

Jalali (2004) indica que para aguas subterraneas donde la composición química es controlada por intercambio cationico, el valor de la pendiente de la recta a la que se alinean los puntos, debe ser igual a -1. De esta forma, puede concluirse que existe un decaimiento de la relación Ca+2+Mg+2, en función de un aumento progresivo de la concentración de Na+, asociado a procesos de intercambio ionico entre el medio poroso y las aguas del acuífero.
Si bien estos no son todos los diagramas que pueden utilizar para analizar los datos de la hidroquimica de agua subterránea, los vistos hasta ahora son los más utilizados.
REFERENCIAS
CUSTODIO, Emilio. Hidroquímica. En: CUSTODIO, Emilio y LLAMAS, Manuel. Hidrología subterránea, segunda edición. Barcelona: Ediciones Omega, 2001. p 1007 – 11095.
DE FREITA, Francisco. Cronel Armando. Caracterización Hidrogeoquímica De Las Aguas Subterráneas Del Acuífero Mesa – Las Piedras. Congreso latinoamericano de Hidrogeología, Venezuela 2010.
LADOUCHE, Bernard y Wueg Philippe. Hydrochemical assessment of the Rochefort marsh: Role of surface and groundwater in the hydrological functioning of the wetland. Journal of Hydrology 314, 2005. p 22–42.
http://www.escet.urjc.es/~jlillo/Tecnicas_Hidrogeoquimicas.pdf
Memorias V Curso Hispanoamericano de Hidrología Subterránea, Uruguay, 2009.